- 檢測SARS-COV-2檢體及檢體之前處理流程
- 檢測SARS-COV-2檢體
- 無症狀者早期診斷建議首選為採集上呼吸道檢體與鼻咽拭子,也可以使用以下檢體替代:包括口咽拭子、中鼻甲拭子、鼻腔拭子、鼻咽沖洗液、鼻咽抽取液以及鼻腔抽取液。
- 針對具有下呼吸道症狀 (例如咳嗽) 的病患,則建議收集下呼吸道檢體如痰液,鼓勵病患自咳痰但不建議引痰。
- 採血取得血清:以無菌試管收集至少 3 mL血清,做為病毒及抗體檢測。
咽喉擦拭液以無菌病毒拭子之棉棒擦拭咽喉,插入病毒保存輸送管。
痰液採集應以清水漱口後,採集深部咳痰。
咽拭子應在咽峽深部(懸雍垂及扁桃腺兩側,利用合成纖維拭子反覆刮取。
鼻拭子應於鼻腔深部使用合成纖維拭子反覆刮取。
- 檢體之前處理流程
- 若是同時採集鼻咽拭子與口咽拭子,則可收集到同一罐含有病毒保存液之容器送檢,以提高測試敏感度。咽喉擦拭液、痰液:病毒培養及病毒RNA檢測
- 檢體操作:
- 生物安全第2等級(BSL-2)實驗室可進行之工作:
- 血清及血液等檢體之常規檢驗(包括血液學和臨床生化學等)
- 將檢體依規定進行三層包裝,外送其他實驗室進行檢驗。
- 於 BSL-2 實驗室且提升人員安全防護及操作要求後,可進行之工作:
- 分裝及/或稀釋檢體。
- 進行接種細菌或真菌培養基。
- 進行不涉及未知病原體在體外或體內增殖之診斷試驗。
- 涉及未經處理之檢體核酸萃取步驟。
- 製備及以化學法或熱固定抹片進行鏡檢。
- 生物安全第2等級(BSL-2)實驗室可進行之工作:
- 病毒培養需在 BSL-3 生物安全等級實驗室操作,用於分離SARS CoV-2病毒的細胞為Vero E6及人類肺細胞Huh7細胞株7,將帶病毒之檢體接種於含16μg/ml trypsin DMEM的Vero E6細胞,於37°C溫箱進行培養,每日觀察其細胞病變情形,於3天後可明顯觀察到細胞變圓及聚集的細胞病變,其培養上清液與細胞分別以RT-PCR及使用SARSr-CoV Rp3 NP antibody進行免疫螢光染色確認病毒,對於後續的研究,分離SARS-CoV 2是站穩成功的第一步。
- 核酸檢驗(Real-time RT-PCR)為確認個案是否感染SARS-CoV-2的黃金標準(Gold Standard)。
- 檢測SARS-COV-2檢體
- 2種目前最常用於檢測SARS-COV-2病毒感染的實驗室診斷方法、原理與實驗技術流程及其優缺點
COVID-19 的致病原是冠狀病毒SARS-CoV-2,檢測方式主要有四種方式:病毒培養、病毒核酸檢測、病毒抗原檢測、病毒抗體檢測。目前最常用於檢測SARS-COV-2病毒感染的實驗室診斷方法為病毒核酸檢測與病毒抗原檢測。- 病毒核酸檢測(Nucleic acid test): 以real time RT-PCR最快速靈敏。
偵測受測者體內是否帶有病毒基因片段。檢測陽性代表受測者體內帶病毒基因,可能正受到感染或在發病前後。這個檢測方法的敏感度高,只要體內有少量病毒即可測出。
由於冠狀病毒不容易用培養的方式分離,因此現在的檢驗方式以即時反轉錄聚合酶鏈鎖反應(real time RT-PCR)檢驗為主,簡單來說是在體外短時間的大量增加特定的基因片段做檢測,以此就可以用少量的檢體來做病毒檢測。
採樣與檢驗的流程簡要流程大約如下:- Step 1:由醫護團隊採樣,樣本可能是痰液、咽喉拭子、血清等,後送至專門的檢驗室,萃取RNA基因。
- Step 2:以選定的三個新型冠狀病毒(SARS-CoV-2)蛋白質的特異性核酸引子(primer)、CYBR Green I與正控制組的人體內原有特定蛋白質 RNA,進行 即時RT-PCR 檢測,CYBR Green I插入複製後的雙股DNA內,螢光與複製量成正比。
- Step 3:根據檢測結果的 Ct(threshold cycle)值作出判定,結果可為陽性、陰性或無法判定。
- 病毒抗原檢測(Antigen test):包括試紙抗原快篩及ELISA技術
以特定抗原的單株抗體來偵測檢體是否帶有病毒抗原。檢測陽性表示正在感染,但其敏感度比病毒核酸檢測低,少量病毒會有測不到的風險。如何提高抗原快速篩檢產品的敏感度及特異性,對於國家整體的防疫措施非常有助益,且可加速患者的分流,並緩和擴大檢驗範圍所造成之檢驗負荷。
快篩試劑內含的試紙可依序分成4個部件:檢體層、膠體金抗體層、硝化纖維膜與吸收層。當含有受檢者呼吸道分泌物的檢體加到檢體層時,因各層纖維中的毛細作用將檢體內液體分子帶向最後方吸收層。檢體中含有新冠病毒蛋白抗原流經膠體金抗體層時,可以識別新冠病毒抗原的單株抗體會認出而與其結合在一起,而此處的單株抗體是已經結合了奈米級膠體金的特製化抗體,也是快篩試劑能夠形成暗紅線條的原因。接著,抗原-膠體金抗體結合物流經有二道線的硝化纖維膜,第一道是測試線,含有能抓住新冠病毒蛋白抗原的抗體,而第二道線則是控制線,有能抓住膠體金抗體分子的抗體。當受檢者體內有新冠病毒時,經硝化纖維膜則會呈現雙線,代表陽性結果。反之,受檢者體內沒有新冠病毒時,只呈現單線結果,代表陰性。
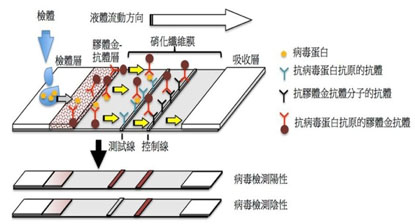
核酸檢測 抗原檢測 優點 準確率高,少量病毒也能驗出 耗時短,快速知道是否感染 缺點 耗時,且需較多的人力,需要專業設備及人力操作 準確率較核酸檢測低,容易有偽陽性及偽陰性發生 - 病毒核酸檢測(Nucleic acid test): 以real time RT-PCR最快速靈敏。
109地方特考三等衛生技術
生物技術
申論題
- SARS-COV-2病毒感染與複製的途徑
SARS-CoV-2是一種具有包膜的正鏈單股RNA病毒,屬於冠狀病毒科β型冠狀病毒屬嚴重急性呼吸道症候群相關冠狀病毒種。新型冠狀病毒雖然被證明和SARS-CoV的基因只有79%的相似度,但它也可以藉由hACE2(血管緊張素轉換酶2 )作為受體結合,通過呼吸道上皮細胞進入肺部進行複製過程為主,但腸上皮細胞也較為易感。其主要作用對象被發現也是與SARS相同的T淋巴細胞。在SARS-CoV-2感染宿主時,hACE2的表達被認為主要局限於第II型肺細胞、吸收性腸上皮細胞和鼻黏膜分泌細胞。而人類結膜及角膜組織中也被發現有較高表達的hACE2和TMPRSS2 (Transmembrane protease serine 2穿膜絲胺酸蛋白酶2),是除呼吸道外的病毒主要感染門戶。SARS的S蛋白與其受體hACE2結合是靠細胞絲胺酸蛋白酶TMPRSS2來引發的。
SARS-COV-2由鼻腔或口腔進入上呼吸道或腸上皮細胞後在接觸宿主細胞時,病毒表面的突莿S蛋白(spike protein)會經由特定的立體結構變化,使RBD(受體結合區域)暴露後與hACE2相結合,接著通過促進S2蛋白介導與細胞的膜融合完成感染的全過程。TMPRSS2和TMPRSS4都可以增強其膜融合活性。SARS-CoV-2在S1上的RBD與寄主細胞中的hACE2結合後,S2中的七肽重複域HR1和HR2會互相作用,形成一個6-HB核心,促進病毒的膜融合。
冠狀病毒普遍被認為在細胞質進行複製和轉錄,其中只有它的RdRp (RNA依賴性RNA聚合酶)是完全保守的。大量RNA基因組複製後,進行病毒組裝,最後經膜融合後,大量病毒釋出到肺細胞或者腸上皮細胞內,完成感染與複製。
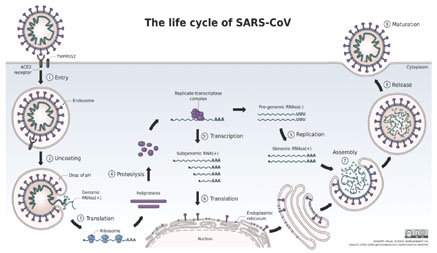
- 蛋白質標靶分子
由上述感染與複製途徑得知,A生物科技公司應以Spike S蛋白質、hACE II、TMPRSS2為標靶分子,利用對抗的抗體或藥物,始能有效阻滯進入人體之SARS-COV-2病毒進入呼吸道細胞。 - 核酸疫苗、重組病毒及類病毒、不活化病毒疫苗與次單元疫苗等4種策略備製SARS-COV-2病毒疫苗之原理、主要差異與優缺點。
- 核酸疫苗
核酸疫苗(nucleic acid vaccine)也稱基因疫苗(genetic vaccine),是指將含有編碼的蛋白基因序列的質粒載體(plasmid vector),經肌肉注射或基因鎗等方法導入宿主體內,在宿主細胞內表達抗原蛋白,誘導宿主細胞產生對該抗原蛋白的免疫反應,以達到預防和治療疾病的目的。
核酸疫苗是利用現代生物技術免疫學、生物化學、分子生物學等技術研製成的,分為DNA疫苗和RNA疫苗兩種。但目前對核酸苗的研究以DNA疫苗為主,。DNA疫苗又稱為裸疫苗,因其不需要任何化學載體而得此名。DNA疫苗導入宿主體內後,被細胞(組織細胞、抗原遞呈細胞或其他發炎性細胞)攝取,並在細胞內表達病原體的蛋白質抗原,通過一系列的反應刺激機體產生細胞免疫和體液免疫。目前最有名的輝瑞與莫德納SARS-COV-2病毒疫苗,應用突莿S蛋白的mRNA經脂球體包覆後,送入細胞質內直接轉譯出S蛋白,誘發毒殺T細胞免疫與抗體免疫。
DNA和RNA疫苗容易設計與量產,也不需要處理感染性物質。SARS-COV-2病毒疫苗中首次用於人體DNA或RNA疫苗。DNA疫苗可能會有致突變性,而RNA疫苗則沒有此風險。
病毒載體疫苗透過良性病毒攜帶遺傳物質到人體細胞,則存在一些病毒載體的免疫性的風險,因為任何免疫性都可能削弱疫苗的效用。
核酸疫苗具有如下優點:- 免疫保護力增強
- 製備簡單,省時省力
- 同種異株交叉保護
- 應用較安全
- 產生持久免疫反應
- 貯存、運輸方便
- 可用於防治腫瘤例如黑色素瘤。
- 質粒DNA可能誘導自身免疫反應
- 持續表達外源抗原可能產生一些不良後果
- 肌肉注射質粒後,僅有很少部分被肌細胞所攝取
- 外來裸露DNA需要送入細胞核內才能轉錄,mRNA在細胞質容易被降解。
- 重組病毒及類病毒
- 重組病毒 (recombinant virus vaccine)
利用重組腺病毒(adenovirus)作為載體將目標蛋白之DNA序列帶入體內,除了沒有傳統疫苗危險性之外,經實驗證明可同時引發先天性免疫(innate immunity)以及特異性免疫(adaptive immunity)反應,達到全面性的保護效果。
腺病毒載體型疫苗的最大優勢在於具有製作簡單、安全、有效的特性,並能夠對使用者產生長期的保護效果,除了注射劑型之外,同時開發的鼻噴劑型將大大降低此種疫苗使用時的不適感且提升方便性。缺點是重組病毒DNA本身可能誘導自身免疫反應。 - 類病毒疫苗 (virus-like particles, VLPs)
類病毒顆粒疫苗是將病毒的蛋白抗原裝配成高度結構化的蛋白質顆粒,直徑大小介於 20-150 nm,保持了病毒抗原蛋白的天然立體結構,因而具備激發宿主先天和適應性免疫反應功能,如:人類乳突病毒 (HPV) 疫苗。此類疫苗類似空包彈,只有病毒空殼以及有病毒的蛋白質顆粒。優點是不具病毒遺傳物質,在人體內無法複製,安全性高。缺點是只能誘發體液性免疫,而無法引發 T 細胞免疫反應。
- 重組病毒 (recombinant virus vaccine)
- 不活化病毒疫苗(inactivated vaccine)
以高溫或化學物質殺死病毒後打入人體中, 病毒的殘骸仍會產生免疫反應,如:小兒麻痺沙克 (Salk) 疫苗、A 型肝炎疫苗、狂犬病疫苗。優點是不活化疫苗的製造相對容易,使用整個病毒有較多蛋白質可做為免疫標的,不會引起感染,較少副作用。但其引起的免疫反應較弱,只能誘發抗體來中和,無法引起更強的 T 細胞毒殺,且常常需要施打多次,追加劑量。
製造有效安全疫苗的過程中,維持SARS-COV-2棘狀S蛋白的完整性非常重要。 - 次單元疫苗(subunit vaccines)
次單位疫苗只傳遞目標抗原(棘蛋白)而非整個病原體到宿主的免疫細胞,進而激發免疫性。S protein 是SARS-COV-2疫苗最主要的標的。次單位疫苗的優點是不具傳染性,相對安全,避開病原體不必要的毒素與妨礙有效性的物質。缺點是要對病原體有較全面性瞭解,知道何種成分較有抗原性,而且未必能產生正確的免疫記憶,次單位疫苗抗原的免疫原性較差,需要佐劑輔助才能誘發足夠免疫性,全球疫苗的產能可能會因此受限。
- 核酸疫苗
- 萊克多巴胺(Ractopamine)及其藥理作用
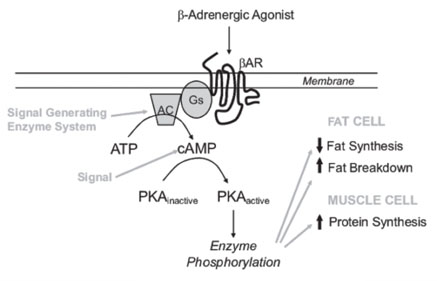
萊克多巴胺(Ractopamine)是「瘦肉精」的一種,分子式C18H23NO3,分子量302,是腎上腺β型受體促進劑(beta-adrenergic agonist),瘦肉精實際上是幾種不同成分的藥物統稱,屬於類交感神經興奮劑,原先研發用於治療人類呼吸道疾病(如氣喘),但沒通過臨床試驗。後來發現瘦肉精添加在禽畜動物的飼料中可以提高瘦肉的比例、降低脂肪比例及加快生長速度,優點包括減少飼養成本、增加利潤、提高糧食自給率及降低排泄物對環境的汙染等,所以被轉作為飼養禽畜動物的飼料添加物。萊克多巴胺是瘦肉精中一種代謝較快、毒性較低的類型,禽畜動物(如牛、羊、豬及火雞等)使用萊克多巴胺後,可以活化β1和β2的交感神經受器,進而刺激肌肉細胞,增加5~10%的蛋白質合成,並減少脂肪合成,達到增加瘦肉的效果。
美國稱在其測定的容許殘留量下(肉類10 ppb)合法使用,將不會對人類造成中毒或短期危害。但目前的實驗數據無法確定其是否會對人體產生其他副作用,人體長期攝取殘留的萊克多巴胺是否會造成健康問題也尚不清楚,但其受試臨床表現較多為心跳過速,面頸、四肢肌肉顫抖,頭暈、頭疼、噁心、嘔吐,特別是患有高血壓、心臟病的病人,可能會加重病情導致意外,且因瘦肉精相關成份多為禁藥組成故國際體育賽事上被禁用。
萊克多巴胺在動物體內與β受體結合,進行二級信息傳遞,經活化G-protein及腺核苷酸環化酶(AC, adenylate cyclase),使ATP環化為cAMP,活化蛋白質激活酶A (PKA, protein kinase A),接著進行一連串蛋白質磷酸化,使交感神經興奮,刺激肌肉細胞,增加5~10%的蛋白質合成,並減少脂肪合成,達到增加瘦肉的效果,如下。
- LC-MS/MS技術,上機前之樣品備製流程
依據行政院衛福部100年4月7日食品中動物用藥殘留量檢驗方法-乙型受體素類多重殘留分析。
檢體之前處理:萃取、淨化、過濾。- 萃取:將檢體細切,以均質機均質後,取檢體約 5 g,精確稱定,置於離心管中,加入0.2 M 醋酸鈉緩衝溶液 15 mL,震盪10分鐘,再加入內部標準溶液及β-葡萄糖醛酸苷酶溶液各100 μL,混合均勻,置於 37℃水浴中水解 1小時。隨後以 4000 rpm 離心 10 分鐘,收集上清液,離心管中之沈澱物再加入0.2 M 醋酸鈉緩衝溶液 15 mL,振盪萃取 10分鐘,於4000 rpm離心10分鐘。合併上清液,以1 N 氫氧化鈉溶液調整 pH值為7.0,再於4000 rpm離心10分鐘,取上清液供淨化用。
- 淨化:取萃取後供淨化用之溶液,注入預先以甲醇 3 mL及去離子水3 mL潤洗之固相萃取匣,以去離子水4 mL清洗固相萃取匣,棄流出液。以甲醇 4 mL 沖提,收集沖提液,於 65℃以氮氣吹乾,殘留物加甲醇:7 mM醋酸銨 (8:2, v/v)溶液1 mL,以旋渦混合器振盪溶解,經 0.2μm 濾膜過濾後,供作檢液。
- LC-MS/MS定量萊克多巴胺含量的檢測技術原理
LC-MS/MS定量萊克多巴胺含量係以液相層析串聯質譜儀(LC/MS-MS)執行對 Ractopamine(萊克多巴胺)等多種乙型受體素類之檢驗,當檢出含有乙型受體素時,則進一步執行三級離子質譜掃描功能(MS),掃瞄特定的二級碎片離子,獲得 MS質譜圖進行比對,並以 MRM模式定量,藉以提高檢驗結果之可信度及準確度。- 檢體及其前處理,已於上述。
- 已知濃度的標準品及其內部標準品。
- 儀器分析:液相層析串聯質譜儀:AB SCIEX 5500 Q TRAP LC/MS/MS System。
- LC:液相層析分離純化萊克多巴胺
- MS/MS:串聯質譜儀,LC後萊克多巴胺再經二次質譜分析,確定分子量。
- 使用之 LC-MS/MS 儀器之型號為 AB SCIEX 5500 Q TRAPR LC-MS/MS System 三段四極桿/線性離子噴灑質譜儀,備有 ElectroSpray Ionization (ESI)及 Atmospheric Pressure Chemical Ionization (APCI)兩種離子源,並搭配 DIONEX series HPLC。
- 高效能液相層析儀(HPLC)條件
分析管柱: Agilent ZORBAX SB-C18,5μm,4.6×150 mm。
分析管柱溫度:35℃
移動相流速:1.0mL/min
樣品注射量:10μL
移動相:5mM 醋酸銨/水(A 液); 5mM 醋酸銨/甲醇(B 液)
移動相梯度: - 串聯式質譜儀(MS/MS)條件
離子源:電灑法(ESI)
氣簾氣體:20
碰撞氣體:High
電灑電壓:5500
加熱溫度:650
霧化氣體:65
加熱氣體:65
偵測模式:多重反應偵測(multiple reaction monitoring, MRM) 離子對(MRM)、真空介面板電壓(DP)、碰撞能量電壓(CE)、入口電壓(EP)、碰撞室初端電壓(CXP):
分析物:萊克多巴胺,離子對: 302/164 & 302/107
 母離子(m/z=302),子離子(m/z=164, 107)
母離子(m/z=302),子離子(m/z=164, 107) - 定量
以 MRM (Multiple Reaction Monitoring)模式做為定量,就檢液與對應標準溶液所得波峰之滯留時間及相對離子強度比(Ion Ratio)鑑別之;當檢出含乙型受體素時,則進一步執行三級離子質譜掃描功能(MS3),掃瞄特定的二級碎片離子,獲得 MS3質譜圖進行比對,並以 MRM3模式定量,依下列計算式求出檢體中各乙型受體素之含量(ppb):
檢體中各乙型受體素之含量(ppb)= C×V/M
C:由標準曲線求得檢液中各乙型受體素之濃度(ng/mL)
V:檢體最後定容之體積(mL)
M:取樣分析檢體之重量(g)
- 高效能液相層析儀(HPLC)條件
- ppb的定義
ppb是part per billion,十億分之一。1/109。 - 若萊克多巴胺最高殘留量是40 ppb,該最高殘留量標準40 ppb可換算成多少ug/kg?
1 kg = $10^3$ g =$10^6$ mg = $10^9$ ug,所以 1ppb = 1 ug/kg,40 ppb = 40 ug/kg。
6S核糖體RNA (16S ribosomal RNA, 16S rRNA),是原核生物的核糖體中30S 次單元的組成部分,16S rRNA的長度約為1,542nt。以細菌與古細菌來說16S rRNA 在演化過程中,改變的程度相當的低,大多數 16S rRNA其中有 V1~V9 共9個高度變異區域 (High Variable Regions, HVRs),透過選擇其中高變區的序列,進行 PCR 專一性增幅放大,經過定序,將序列作為分類與鑑定環境或生物體內微生物之種類與群落。隨著次世代定序的科技發展,與生物資訊分析的演進,重新給予 16S rRNA 一個新定義,除快速與大量的提供既有的種類分類研究,更進入全新物種或未被成功培養物種的研究新手段。
16S rRNA定序的前500個鹼基序列,對於鑑定到”種(species)的等級”是很有用的數據,但對於更相似的種(species)或株(strains)鑑定上,使用限制酶的分析方式較適合,可有效地展示菌株間(strain-strain)的不同。
由於相同菌種具有高度保存性的16S rRNA基因(16S rDNA),16S rDNA常被用於對各種生物進行的系統發生學方面的研究。在獲得能提供系統發育學信息的16S rRNA分子時需要利用通用PCR primer對16S rRNA分子進行擴增。16S rRNA序列的對比分析需要在這類「通用引物」的DNA分子的輔助下完成,這類分子具有如下序列:
- 8UA正向:5'-AGA GTT TGA TCM TGG CTC AG-3'
- 519B反向:5'-GTA TTA CCG CGG CKG CTG-3'
- 反向:ACG GCT ACC TTG TTA CGA CTT
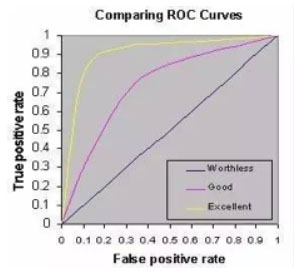
受試者工作特徵曲線(receiver operating characteristic curve, ROC curve)表示一個特定的診斷方法對區別特定的患者組與非患者組樣本的檢測性能。表示不同診斷水平的真陽性率對偽陽性率的函數關係。ROC曲線是以試驗的靈敏度(真陽性)為縱坐標(y軸)、以偽陽性率(1-特異度)為橫坐標(x軸),橫軸與縱軸長度相等,形成正方形,由不同決策界值產生靈敏度和特異度在坐標上都成為圖中一個點,將這些點連接成線,即為ROC曲線,用於①選擇最佳的信號偵測模型、捨棄次佳的模型。②在同一模型中設定最佳閾值。
ROC空間將偽陽性率(FPR)定義為 X 軸,真陽性率(TPR)定義為Y軸。
- X-軸單位1-specificity (FPR)與Y-軸單位sensitivity (TPR)的意義。
- X-軸單位1-specificity (FPR):
圖形橫軸(x-axis)為偽陽性率(false-posiitive rate, FPR),以1 – 特異度(specificity)表示,特異度係將結果正確判斷為負向或陰性的機率。FPR在所有實際為陰性的樣本中,被錯誤地判斷為陽性之比率。 - Y-軸單位sensitivity (TPR):
圖形的縱軸(y-axis)為真陽性率(true positive rate, TPR),又稱為敏感度(sensitivity);而敏感度為將結果正確判斷為陽性的機率。TPR在所有實際為陽性的樣本中,被正確地判斷為陽性之比率。
當指定一個分界點(cut-point)來區分檢驗的陽性與陰性時,這個分界點會影響到診斷工具的敏感度(sensitivity)及特異度(specificity)。在醫學上,敏感度表示有病者被判為陽性的機率,而特異度表示無病者被判為陰性的機率。在曲線上的任何一個點都會對應到一組敏感度與1-特異度,而敏感度與特異度會受到分界點移動的影響。
- X-軸單位1-specificity (FPR):
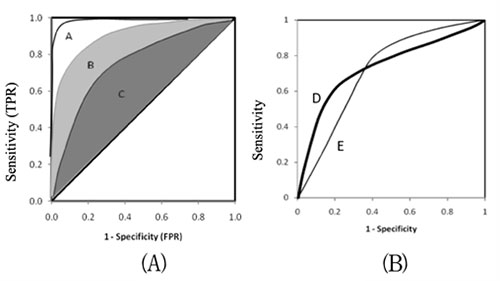
- ROC分析會提供ROC 曲線下面積(area under the ROC curve, AUC),其功能在於告訴我們這個新量表具備多準確的篩檢能力,ROC曲線下面積越大,表示新量表篩檢的準確度越高,以下表格為詳細的判斷標準依據。
ROC曲線下面積的判斷標準:ROC曲線下面積 AUC 判斷結果 0.9以上 準確性較高 0.7 - 0.9 準確性中等 0.5 - 0.7 準確性較低 0.5以下 準確性不良 - 根據(A)圖,A法AUC值最大,效果大於B與C。
根據圖(A): A > B > C - 根據(B)圖,D & E 檢測法的AUC值幾乎一樣,當需要高Sensitivity(TPR)時,E法比D法好,當需要高Speciticity(FPR)時,D法比E法好。
※本站所有內容皆為志光教育科技集團版權所有,未經同意請勿任意複製、轉載、發行或刊他處。