| 擬答 完全命中100%,詳見105志聖阮籍老師 食品微生物學講義A01,P.193-194。 ㈠ 「活而不能培養微生物」與「代謝受傷微生物」:
㈡ 「代謝受傷微生物」之存在對食品病原菌檢測結果 食品病原菌之檢測管制常為「不得檢出」,但因測試樣品曾經凍藏、或加熱等處理,可能含有受傷之病原菌(未死),造成檢驗誤差。 因此通常需將樣品均質液放在適當非選擇性培養液中短暫時間(1~4 h),使受傷菌復原,再以選擇性培養基分析之。 |
| 擬答 完全命中100%,詳見105志聖阮籍老師 食品微生物學講義A01,P.149-156。 平板計數法是食品檢驗中最常用來測定細菌數量的方法,將樣品打碎均質後,經一系列稀釋,再塗於滅菌的平板計數培養基(plate count agar, PCA)上培養,計算活菌菌落述的方法。因培養細菌時通常置於有氧環境下,故又稱為好氧性平板計數 (aerobic plate count, APC)。測得總平板菌落數(total plate count, TPC),一般稱為總菌數、生菌數。將樣品適當稀釋後,接種在固體洋菜培養基上,經培養後,根據培養基上長出的可見菌落(colony)數來推算樣品中所含細菌量,並以菌落形成單位(colony forming unit,CFU)來做為計算的單位。 結果能代表食品中的菌數,是基於二個假設的成立:
|
平板法的二種不同操作方法
|
| 擬答 完全命中100%,詳見105志聖阮籍老師 食品微生物學講義A01,P.9-12。
|
| 擬答 完全命中100%,詳見105志聖阮籍老師 食品微生物學講義A02,P.16-17、P.80-82。 ㈠ 何謂 Kefir: 將牛乳或羊乳煮沸後,冷卻至25℃接種混有乳酸菌與酵母菌之克弗麴 (Kefir grain)於23~25℃保溫過夜,直至乳酸濃度達0.68~0.9%,經過濾後即得具奶油均勻特性及發泡性的酒精發酵乳(alcohol fermented milk),是謂克弗爾 (Kefir)。克弗爾粒在牛乳中會同時進行乳酸菌的乳酸發酵和酵母菌的酒精發酵,而形成獨特的克弗爾發酵乳。在克弗爾成品中,各種乳酸菌的含量大概有 106~ 109菌數/ml,而各類酵母菌的含量則在106~ 108菌數/ml之間。乳酸菌代謝所產生的酸,再加上酵母代謝產生的二氧化碳和微量的酒精,使克弗爾同時具有酸味、淡淡的酒精風味和碳酸的刺激風味等獨特的味道,所以又有「牛乳酒」的別名,也經常被稱為「香檳酸乳酪」。 克弗爾 (Kefir)發酵的主要微生物:
㈠ 微生物所引起之「食品腐敗」:
|
| 擬答 完全命中100%,詳見105志聖阮籍老師 食品微生物學講義A01,P.182-184。 聚合酶鏈鎖反應(PCR)為用以快速擴增DNA片段的方法,PCR這項技術是由凱利•穆利斯(Kary Mullis)在1986年發展出,利用一種人工和反覆相同程序的方法,並利用一種特殊的酶—即耐熱性DNA聚合酶來擴增特定的DNA片段。 其應用原理包括三個重複進行的步驟:三個重複步驟形成一個循環。
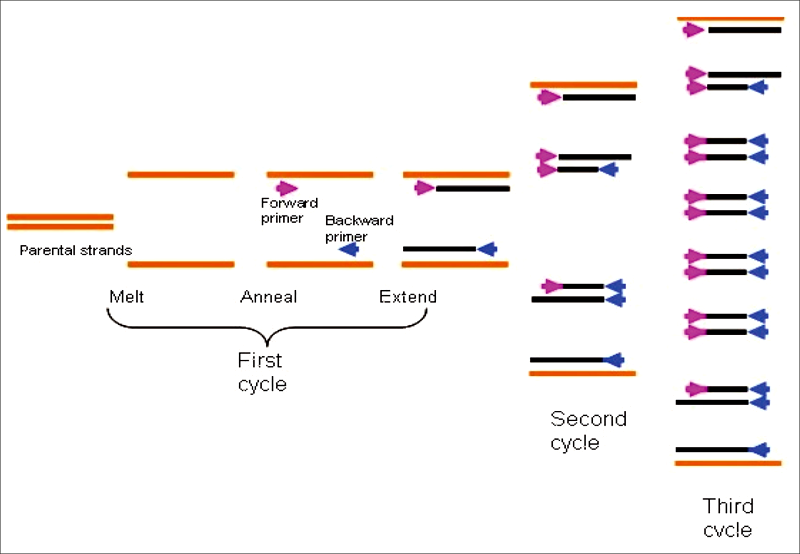 多重PCR(multiplex PCR),又稱多重引物(primer)PCR或複合PCR,它是在同一PCR反應體系裡加上二對以上primers,同時擴增出多個核酸片段的PCR反應,其反應原理,反應試劑和操作過程與一般PCR相同。一般PCR僅應用一對primer,通過PCR擴增產生一個核酸片段,主要用於單一致病因子等的鑑定。 產生腸毒素stx1 及 stx2 的大腸桿菌的多重聚合酶鏈鎖反應(Multiplex PCR):
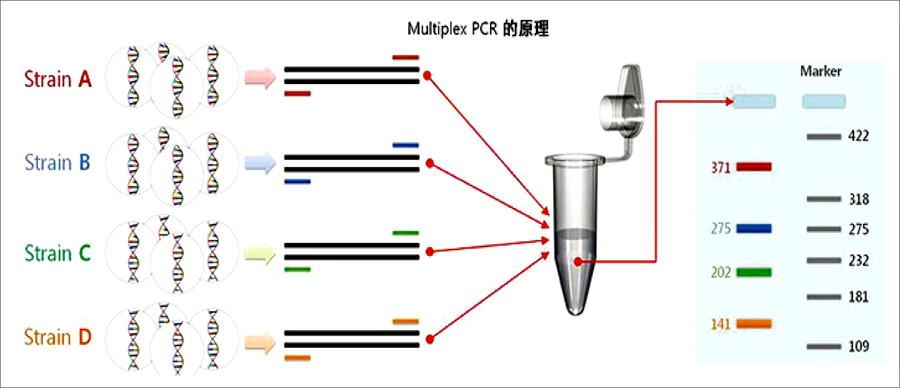 |