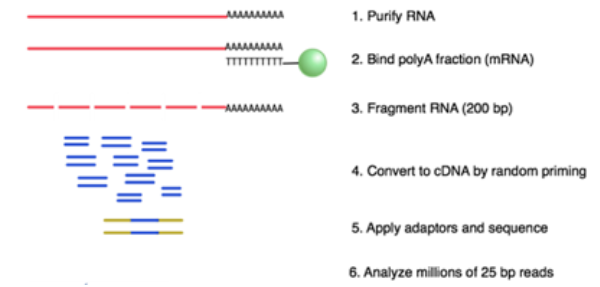
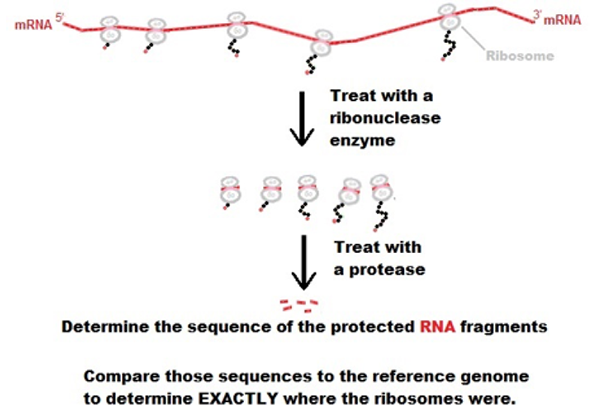
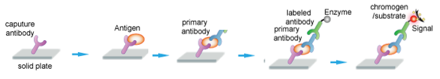
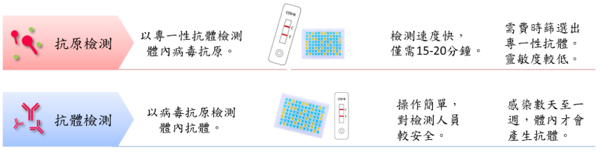
【命中特區】志聖生物技術學A01, p160-163, p165-166, p76-82
- 短干擾RNA (short interfering RNA, siRNA)
RNA干擾簡稱RNAi (RNA interference),是一種細胞內RNA干擾現象或系統,能夠干擾標的細胞內特定mRNA,直接降解或抑制進一步的轉譯,因此可以控制基因轉錄後的蛋白質表達,稱為RNA干擾。能夠干擾、控制基因轉錄後的蛋白質表達的小分子RNA,則稱為siRNA或miRNA或人工合成的shRNA等。
在發育生物學上,常用於線蟲(C. elegans)、果蠅或酵母菌的基因研究,RNA干擾有效的"沈默"特定基因,可以抑制HIV病毒的感染與複製上。
RNA干擾現象在1998年首度於線蟲中發現,利用雙股的RNA(dsRNA)並將其送到細胞中後,dsRNA會被一種名為Dicer的酵素分解成許多小片斷。這些小片斷的RNA(Short interfering RNA,簡稱siRNAs)結合到特定序列之RNA上,引發RNA序列的降解,使mRNA 無法轉譯蛋白質,造成該特定基因"沈默 (gene silencing)",失去功能。
RNAi作用原理與機轉:
RNA病毒或合成的特異基因dsRNA ,經由感染或其他方法送入標的細胞內,此種dsRNA會誘導細胞內一種稱為Dicer的酵素 (RNase III endonuclease) 的表現,Dicer利用其dsRNA特異內切酶活性將dsRNA切成21-23 nt的小RNA片段,這些小RNA片段被稱為siRNAs (small interfering RNAs),siRNA的3’端有2個核苷酸的凸出,這些siRNA本身可以大量複製。
Dicer 結合於siRNA,利用本身的helicase活性將siRNA解開為單股,此時單股的siRNA再結合另一種稱為金羊毛 (Argonaute)的 dsRNA特異內切酶 ,在GTP/Mg2+存在下,siRNA/Dicer/Argonaute/ ATP/Mg2+形成RNA誘導的沉默複合物 (RISC, RNA-induced silencing complex),RISC會利用它的siRNA片段結合到細胞內轉錄的mRNA互補區,隨後,RISC利用Argonaute RNase III活性,水解細胞內mRNA,使得特異性基因無法進一步被轉譯。此一過程稱為RNA干擾現象,其結果是:特定基因被沉默(gene silenced)或被剔除(gene knock-outed)。 -
短髮夾RNA (short hairpin RNA, shRNA)
短髮夾shRNA(Short hairpin RNA)是2002年Brummelkamp首次使用,在小老鼠U6啟動子之後構建shRNA表現載體pSUPER。含shRNA構建的表現載體pSUPER經送入寄主細胞並表達該載體,證明此種shRNA特異性的踢除哺乳類動物細胞內標的基因,為利用RNAi於特定基因治療研究訂定了基礎。
U6 RNA由RNA聚合酶 III 轉錄,伴隨其後端的構築shRNA被RNA聚合酶 III所轉錄,因為設計成sense 與antisense的相互配對,二者中間則非互補配對序列,因此轉錄出一緊密的髮夾形狀shRNA。
shRNA與RNAi/miRNA一樣,都可以誘導標的mRNA的降解,但是shRNA可以經由人為意志,利用基因工程技術,構築強力啟動子表現載體,因此,在應用功能上遠比miRNA要強。
建構shRNA表現載體時,合成dsDNA片段(含sense-loop-antisense)受控於啟動子,轉錄出25-29 nt的髮夾形shRNA。shRNA是一種形成急轉彎型(hairpin turn)結構的RNA序列,可以經由RNA干擾現象使特異基因沉默化。
shRNA可利用載體導入細胞當中,如果是接在U6啟動子後,則寄主細胞內的RNA 聚合酶III可以確保shRNA的轉錄。
shRNA在細胞質內經由Dicer剪切成21-23鹼基的siRNA,與siRNA、miRNA相同的原理,最後以RISC結合降解標的mRNA。 - 抗體 (antibody)
抗體(antibody),又稱免疫球蛋白(immunoglobulin,簡稱Ig),是一種主要由漿細胞分泌,被免疫系統用來鑑別與中和外來物質如細菌、病毒等病原體的大型Y形蛋白質,僅被發現存在於脊椎動物的血液等體液中,及其B細胞的細胞膜表面。抗體能通過其可變區唯一識別特定外來物的一個獨特特徵,該外來目標被稱為抗原。蛋白上Y形的其中兩個分叉頂端都有一被稱為互補位(抗原結合位)的鎖狀結構,該結構僅針對一種特定的抗原表位。這就像一把鑰匙只能開一把鎖一般,使得一種抗體僅能和其中一種抗原相結合。抗體和抗原的結合完全依靠非共價鍵的相互作用,這些非共價鍵的相互作用包括氫鍵、凡得瓦力、電荷作用和疏水作用。這些相互作用可以發生在側鏈或者多肽主幹之間。正因這種特異性的結合機制,抗體可以「標記」外來微生物以及受感染的細胞,以誘導其他免疫機制對其進行攻擊,又或直接中和其目標,例如通過與入侵和生存至關重要的部分相結合而阻斷微生物的感染能力等,就像通緝犯上了手銬和腳鐐一樣。針對不同的抗原,抗體的結合可能阻斷致病的生化過程,或者召喚巨噬細胞消滅外來物質。而抗體能夠與免疫系統的其它部分交互的能力,是通過其Fc區底部所保留的一個糖基化座實現的。體液免疫