- 流式細胞儀檢測細胞特性的原理
流式細胞儀(Flow cytometry)主要由流體學系統(fluidics)、光學與電子系統(optics and electronics)組成。待測樣本中的細胞經流體系統傳送,依序地通過雷射照射區域,細胞受雷射激發而產生訊號,訊號接收器接收到訊號後會放大訊號,將這些訊號輸入電腦分析處理,電腦再將資料處理後變成圖形顯示在螢幕上。
流式細胞儀產生並分析的信號主要有光散射信號和螢光信號,藉由光訊號的強弱和波長不同,可以得到細胞大小、型態與顆粒化等資訊。螢光訊號可提供不同細胞生物學特性並應用於許多實驗中。 - 流式細胞儀檢測細胞特性的應用
- 細胞週期分析
在細胞週期進行時,DNA含量會隨著細胞進入不同周期而有增減,利用螢光對細胞進行相對DNA含量測定,可以分析細胞各個週期的百分比。 - 細胞凋亡的分析
細胞凋亡又稱為程序性細胞死亡,在細胞接收到血液或組織液中特定的訊號因子時,會觸發一連串連續性的細胞變化,最後導致細胞死亡,但這樣的細胞死亡行事不會影響周圍健康的細胞,是一種細胞自然的淘汰機制。
細胞凋亡最常使用的是Annexin V-PE染色,可以快速分析早期細胞凋亡。細胞凋亡早期會有膜磷脂醯絲氨酸phosphatidylserine(PS)由細胞脂膜內側翻向外側的現象,Annexin V會結合到磷脂蛋白上的鈣離子,接上PE呈色,可被波長488 nm左右激發,另外以PI染色細胞核可以分辨早期凋亡與死細胞。
細胞凋亡的檢測在抗癌藥物的研究中應用廣泛,通常配合細胞週期分析結果,作為判斷標的藥物抗癌效果的依據。 - 細胞型態的分析
前散射光(FSC)可以分析細胞大小、測散色光(SSC)可以分析細胞的顆粒性,利用此特性可以分別細胞是否健康;正在凋亡程序中的細胞FSC會變小,SSC是先增加後減少,利用此原理可以定性細胞。 - 細胞內pH值測定
螢光染料激發光譜或是發射光譜是會隨pH值而不同的,在生理的pH值內,螢光比例與pH值擁有很好的線性關係,因此,可以用螢光的比例推算pH值。 - 細胞內鈣離子濃度測定
利用特殊螢光染料(Furd-Red、Fluo-3、Rhod-2等)通過乙醯甲脂(AE)導入細胞後會與鈣離子有特異性結合,螢光的激活或發射性與鈣離子濃度有關,可利用比例法或是直接檢測螢光而得到鈣離子濃度。 - 腫瘤學應用
腫瘤學研究是流式細胞技術在臨床醫學中最早的應用。人體中正常組織要明確變質並確診癌症需要很長的時間,而流式細胞儀可以偵測出癌前細胞"量"的增多,進而發現癌前病變的部位,簡單來說,正常人體細胞有穩定的DNA二倍體量,通常癌變的細胞會不正常增生,而流式細胞技術可以精確得檢測出DNA含量變化,是癌前病變的一個有價值指標。 - 免疫學應用
流式細胞技術通過螢光抗原抗體檢測技術分析細胞表面抗原,進行細胞分類和亞群分析,此一技術對於人體細胞免疫功能的評估具有重要貢獻。正常人類淋巴細胞T4:T8=2:1,但在人體免疫低下時可能出現倒置,變成1:2,T4與T8的比值也可用來監測腎移植後病人的排斥反應,此技術也可用於愛滋病的診斷和治療中。流式細胞技術也可以在血液中篩選白細胞、顆粒細胞與淋巴細胞。 - 血液學應用
流式細胞技術在血液學中,主要用於白血病的診斷和治療,利用細胞表面抗原的單株抗體並結合螢光,量測細胞的各式參數以正確判斷該細胞屬性。細胞表面抗原的專一性對於白血病診斷有決定性的作用。造血幹細胞表現CD34;B細胞表現CD10、CD19、CD20等與T細胞表現CD2、CD5、CD7等。
異體造血幹細胞移植也需仰賴流式細胞技術,其中所需的幹細胞鑑別,活性測定,幹細胞採集、分離與純化等,流式細胞技術都是不可或缺的。 - 藥理學應用
多重耐藥性(Multidrug Resistance, MDR)是指對幾種自然產生的細胞毒素交叉抗性,是化療的主要障礙之一。MDR可能因為跨膜P-醣蛋白的高表達和細胞內藥物重新分配異常,而使細胞內藥物在有效部位的射入量減少。在結構方面可以檢測P-gp的高表達,在功能方面可檢測抗腫瘤藥物的細胞內積聚程度,從而判斷藥物是否有作用在正確的地方。
利用BrdU染色DNA,可以準確測定DNA合成速率,依據DNA直方圖的變化來判斷化療藥物的作用機制或療效。
- 細胞週期分析
110普考衛生技術
生物技術
申論題
接種疫苗是預防疾病最有效的方式。疫苗的原理是將病毒或細菌的抗原或遺傳物質打入人體,病毒和細菌入侵後,就開始攻擊人體和進行複製,同時也啟動我們的免疫系統製造抗體。
- 目前全球COVID-19疫苗種類
- mRNA 疫苗:
- 莫德納 mRNA-1273
- 輝瑞/BNT BNT162b2
- 病毒載體疫苗:
- 牛津/阿斯利康 Oxford/AstraZeneca AZD1222
- 嬌生嬌生 J&J/Janssen
- 康希諾 CanSino
- 加馬列亞Gamaleya (Sputnik V)
- 蛋白質次單元疫苗:
- Novavax 的蛋白質次單元疫苗 NVX-CoV2373
- Sanofi 和 GlaxoSmithKline(GSK)
- 高端疫苗MVC-COV1901。
- 不活化(滅毒)病毒疫苗:
- 國藥 SinoPharm
- 興科CoronaVac
- mRNA 疫苗:
- 目前全球COVID-19疫苗製造
- mRNA 疫苗
mRNA 全名為信使 RNA(messenger RNA),可將特定蛋白質的製造指示送至細胞核糖體(ribosomes)進行生產。mRNA 疫苗會將能製造新冠病毒棘狀蛋白的 mRNA 送至人體內,並不斷製造棘狀蛋白,藉此驅動免疫系統攻擊與記憶此類病毒蛋白,增加人體對新冠病毒的免疫力,最終 mRNA 將被細胞捨棄。
此種棘蛋白mRNA經pseudoUridine修飾,以LNP (lipid nanoparticle)包覆,不需其他佐劑送至人體內,由於 mRNA 疫苗並無攜帶所有能製造新冠病毒的核酸,且不會進入人體細胞核,所以施打疫苗無法使人感染新冠病毒。 - 病毒載體疫苗
病毒載體疫苗通常會用腺病毒(adenovirus)傳遞至人體。製造病毒載體疫苗首先得將病毒載體的自我複製能力消除,再將一段製造病毒棘狀蛋白的 RNA 或 DNA 放入腺病毒基因序列中,最後遞送至人體細胞,製造抗原刺激免疫系統。- AZ/Oxford疫苗,
每0.5mL內含成分包括不低於 2.5 × 10的8次方感染單位 (Inf. U)之黑猩猩腺病毒(ChAdOx1)顆粒、鈉(含量低於 1 mmol)、乙醇2mg與賦形劑,並不含佐劑與防腐劑。 - 由莫斯科 Gamaleya 研究院(Gamaleya Research Institute)與俄羅斯國防部共同開發的新冠疫苗 Sputnik V(衛星五號)也是此類。Sputnik V 會透過腺病毒5(adenovirus 5)將DNA打入人體細胞,接種2劑後預計產生2年新冠病毒免疫力。
- Johnson & Johnson 子公司 Janssen 製造的重組病毒載體疫苗 JNJ-78436735 (Ad.26.COV2.S)。疫苗採用人類腺病毒 Ad26 誘發免疫反應,疫苗預計能在-20°C維持穩定2年,2°C至8°C的環境下保存至少3個月。嬌生疫苗只需施打1劑即可產生功效。
- AZ/Oxford疫苗,
- 蛋白質次單元疫苗
蛋白質次單元(protein subunit)疫苗能以更直接的方式刺激免疫系統。將結合類病毒奈米粒子的蛋白質傳遞至患者體內,免疫系統即可迅速產生抗體,相比透過 mRNA 或其他核酸來製造棘狀蛋白還直接。- Novavax 的蛋白質次單元疫苗 NVX-CoV2373 是將新冠棘狀病毒透過桿狀病毒(baculovirus)遞送至蛾細胞,藉此製造蛋白,隨後和基底為皂苷(saponin)的佐劑混合製成。
- Sanofi 和 GlaxoSmithKline(GSK)則使用桿狀病毒生成棘狀蛋白來製造疫苗。合作中,Sanofi 提供重組 S 蛋白 COVID-19 抗原,GSK 則是供給佐劑。
- 高端疫苗的新冠疫苗 MVC-COV1901 是以三聚體結構呈現的 S-2P 全長基因修飾重組棘蛋白為疫苗抗原,開發案轉自美國國衛院(NIH)。
- 不活化(滅毒)病毒疫苗
國藥 SinoPharm與興科CoronaVac是都是滅活疫苗,由已殺滅的病原體製成,主要通過其中的抗原誘導細胞免疫的產生。滅活疫苗屬於比較傳統的方式,使用廣泛。
- mRNA 疫苗
- 目前全球COVID-19疫苗差異
- mRNA疫苗所用mRNA都經過 pseudoUridine修飾,莫德納儲存溫度-15~-25°C,具備在 -20°C 儲存超過 30 天的優勢。輝瑞/BNT儲存溫度-60~-80°C,若轉置到 2~8°C 冷藏設備,必須於 5天(120小時)內 使用完畢。mRNA疫苗可短期大量製造,適合疫情緊急狀況,快速製造,容易修改鹼基對抗新冠病毒變異株。肌肉注射二劑,抗體表現方面,接種第 1 劑 mRNA 疫苗後,受試者體內病毒抗體濃度增加,但是增加幅度沒有接種第 2 劑後來得高。接種第 2 劑 mRNA 疫苗後不僅抗體濃度提高,更令人意外的是,追加施打會誘導單核球生成,單核球是先天免疫系統的一環,它分化成的巨噬細胞可以大量吞噬病毒。mRNA 疫苗的整體保護力可達94-95%。
- 病毒載體疫苗均使用腺病毒載體,容易進入細胞產生抗體,冷藏儲存溫度 2~8°C,肌肉注射AZ二劑、嬌生一劑,保護力可達66-70%。
- 毒載體疫苗與 mRNA 疫苗最大的不同在於疫苗穩定度,因為主要使用穩定度較高的 DNA,結構上的不同使病毒載體疫苗能在 2°C ~ 8°C 儲存 6個月。對於偏鄉與基礎交通建設不完全的國家與地區來說十分有利。
- 高端MVC-COV1901是用重組棘蛋白為疫苗抗原,成份單純不含病毒,安全性較高,肌肉注射二劑,保護力未知。二劑俄國加馬列亞衛星五號含有新冠病毒的 S 抗原,所以能進入細胞且產生免疫反應。
- 不活化(滅毒)病毒疫苗
科興與國藥疫苗主要的優勢在於它能夠在常規冰箱溫度下(2°C ~ 8°C)保存,病毒經過滅活處理後會改變病毒的立體結構而影響有效抗體的生成,但大致上抗體的殺滅病毒威力還在。
腸病毒為一群病毒的總稱,在1997年以前,已知而被分類的腸病毒共有小兒麻痺病毒(poliovirus)、克沙奇病毒(coxsackie virus)、伊科病毒(echovirus)及腸病毒(enterovirus)等。近年來又陸續發現多種型別,依據基因序列分析結果將之重新歸類,分為人類腸病毒 A、B、C、D 型(human enterovirus A、B、C、D)。
新生兒腸病毒感染的常見病毒型為伊科病毒和克沙奇 B 型病毒,其中以伊科 6、9、11、19、30 型,克沙奇 B1-B5 型病毒較為常見。
目前所使用的方法包括病毒分離及血清學檢驗與反轉錄酵素-聚合酵素鏈鎖反應(reverse transcriptase-polymerase chain reaction, RT-PCR)檢驗等。
- 血清學檢驗
可協助病毒的診斷,運用酵素免疫分析法(ELISA)偵測特異性 IgM抗體的存在;中和試驗(Neutralization test)偵測急性期與恢復期兩者血清IgG抗體,均可證明近期是否曾遭受腸病毒感染。-
酵素免疫分析法(ELISA)偵測特異性 IgM抗體的存在
腸病毒IgM Capture ELISA,除具備敏感、快速之優點,更可做為新近感染之指標。而利用此方法檢驗腸病毒重症患者血清,可在 4 個小時內快速測定腸病毒 71 型的感染,可做為初步篩檢之用。
腸病毒 71 型免疫球蛋白M快速檢驗試劑係利用免疫層 析檢測技術(immunochromotographic test, ICT),及 Capture ELISA 之設計原理,以 rabbit anti-human IgMµ-chain 抗體捕捉病患檢體中抗腸病毒 71 型 IgM 抗體,再與 EV71 C4-B5重組蛋白相互反應後,利用抗 VP1 重組蛋白單抗乳膠顆粒做為呈色系統,可同時提試劑之特異性與靈敏度。不需特殊儀器、操作簡單、 使用方便,於極短時間(20 分鐘)內即可完成判讀結果。
將兔抗人類 IgMµ 鏈抗體(Rabbit anti-Human-IgM µ-chain)固定於 T 線區域上, 並以抗 VP1 重組蛋白單抗乳膠顆粒(MAb anti-VP1 Latex)為呈色劑,以夾心法 檢測檢體內是否含有抗腸病毒 71 型的 IgM 抗體。
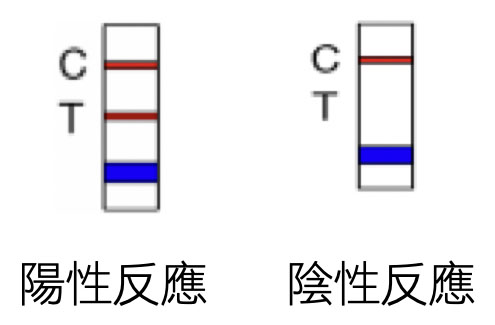
陽性反應(Positive): 判讀區內於 C、T 兩區分別出現色帶,表示受測者檢體中帶有抗-EV71 之 IgM 抗體。
陰性反應(Negative): 判讀區內僅 C 區出現色帶,表示受測者檢體中無抗-EV71 之 IgM 抗體,或 抗-EV71 之 IgM 抗體效價低於本產品可偵測值。
- 中和試驗(Neutralization test)
所有血清檢體皆以中和抗體檢驗判定中和抗體效價,首先將血清樣本以1:8的比例稀釋(血清100μl加PBS 700μl),加熱 56°C30 分鐘後,再依系列稀釋後加入71型腸病毒培養,第4天判定血清中和抗體價,即對照細胞形態正常,而對照血清檢體對細胞發育無不良影響或者是有毒性,但其倍數不影響中和抗 體價之判定者,則最高血清稀釋倍數之50﹪能完全阻止細胞病變作用(cytopathic effect, CPE),即為該血清之中和抗體價。
-
酵素免疫分析法(ELISA)偵測特異性 IgM抗體的存在
- 分子檢測技術:反轉錄酵素-聚合酵素鏈鎖反應(reverse transcriptase-polymerase chain reaction, RT-PCR)
新型的分子檢測方法-保留簡併性雜交寡核苷酸引子(COnsensusDEgenerate Hybrid Oligonucleotide Primer, CODEHOP),可以同時檢測和鑑定所有的腸病毒型別以及親緣相近的一些病原體。此外,CODEHOP 可以擴增腸病毒序列中具有高度變異性的基因 (VP1) 而不是保守區域 (5’NTR),更有效率可以區別腸病毒的血清型。
反轉錄酵素-聚合酵素鏈鎖反應是將樣品RNA分離,再以反轉錄酶反轉錄為cDNAs,隨後以腸病毒特異性基因引子經聚合酵素鏈鎖反應,以2的n次方放大,期間可以加入CyBr Green I 產生螢光,做為即時定量PCR (real-time RT-PCR),非常靈敏、快速偵測特異性腸病毒。
RT-PCR利用設計好的特殊核酸序列與檢體內可配對的核酸結合以大小量複製到可偵測的濃度。這種檢驗具有很高的敏感度,而且檢驗時間只需數小時。
測腸病毒分型種類有23種基因型,包括COXA2、COXA4、COXA5、COXA6、COXA9、COXA10、COXA16、COXA21、COXA24、COXB1、COXB2、COXB3、NCB3、COXB4、COXB5、COXB6、ECHO4、ECHO6、ECHO9、ECHO30、ECHO11、EV-D68、EV-71,敏感度達50~5000 copies/Rx;與病毒培養比較,在Echo 4及其他型別腸病毒各有80%及100%之檢出率。
流感是由「流感病毒」所引起的急性呼吸道疾病,流感病毒有A、B及C型,D型病毒尚未有人感染的報告。A型和B型幾乎每年引起季節性的流行,C型則以輕微的上呼吸道感染為表現,且一般認為不會造成流行。主要感染人類的A型流感病毒為H 1 N 1與H 3 N 2 (血球凝集素(HA, hemagglutinin)、神經胺酸酶(NA, neuraminidase),H有1-16種、N有1-9種、總共有可能16x9=144亞型,B型流感病毒的B/Victoria及B/Yamagata兩種系。
流感病毒分型快篩原理:
常見的流感快篩試劑則是以血清學為基礎,以ELISA 或抗原快篩技術。
因為具有快速及操作方便(肉眼即可判讀)的優點,為最普遍的篩檢工具。
快篩原理是以血清學為檢驗的原理,利用免疫色層分析法先將對抗流感病毒抗體固定在醋酸纖維試紙上,運用流體帶動檢體,結合後利用酵素呈色反應。呈色後肉眼判讀,具有快速(10-30分鐘)及操作方便(肉眼即可判讀)的優點。快篩檢驗結果的特異性可達到90-95%,且可區別A型流感及B型流感,陽性結果幾乎就可以確定患者遭受流感病毒感染。這類試驗優點是操作簡單、報告快;缺點是病毒量低時易造成偽陰性。>
HN Ab + HN HN Ab—HN HN Ab-HN—HN-2抗—Alkaline phosphatae +受質 (pNpp, para-nitro-phenol-phosphate) p-nitro-phenol (A410, 呈黃色)。
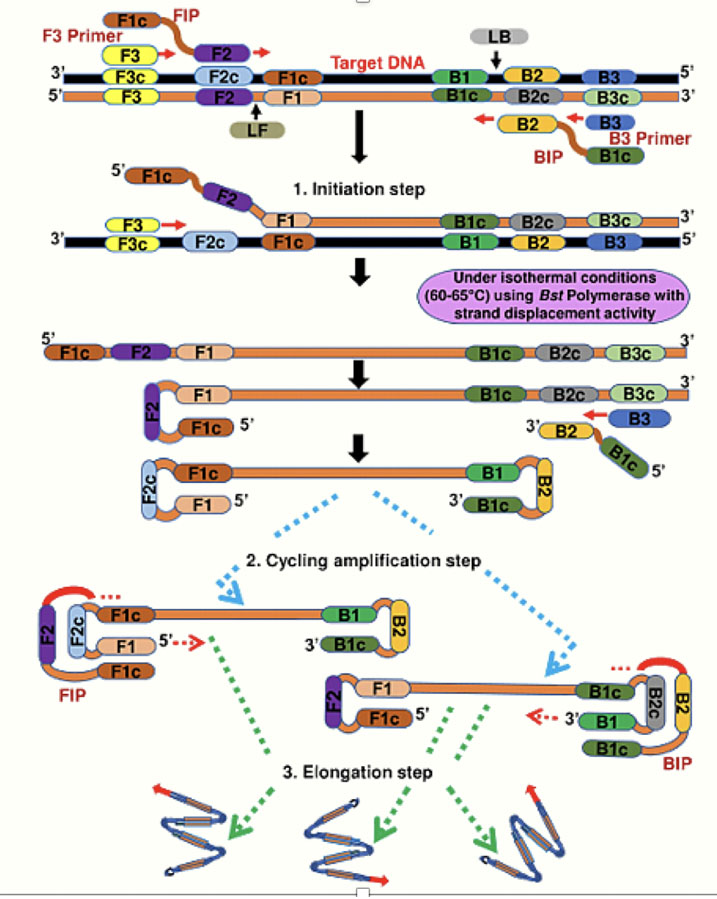
LAMP全名為 Loop-Mediated Isothermal Amplification,是日本公司在2000年研發出的核酸檢測技術,商品於2002 年正式上市至今。LAMP 使用4~6 條 primers,在 65°C恆溫環境下,1 小時內即可完成 DNA 或 RNA 增幅反應。由於反應時間短,且專一性與靈敏度都比傳統 PCR 高出許多,又可直接以肉眼辨識反應結果,LAMP 常被用於病原檢測及其他基因檢測等。
LAMP 一小時增幅1010 倍 (100 億倍),PCR 2-3小時增幅107倍 (1千萬倍),相差1000倍。
- LAMP分子檢測技術原理:
LAMP 的原理主要可分為三點- 特殊的 Polymerase,以Bst Polymerase催化,在 65°C恆溫增幅,可打開雙股DNA (無須高溫 denaturing)。
- 特殊的primer設計,4條primer 針對6個區域,LAMP 除了基本的4條 primer,還可以加入loop primer來加速反應進行。依據基本的4條 primer 的位置,可以設計出0 ~ 2 條 loop primer,因此 LAMP 使用的 primer 數量最多為6條。酵素與 primer 在 65°C恆溫反應下,形成環型DNA構造,最後形成長鏈狀產物。
- 偵測原理,LAMP 若成功增幅 DNA 時,會釋放出焦磷酸根。焦磷酸根會和反應溶液中的鎂離子形成不溶於水的焦磷酸鎂,產生肉眼可見的白濁色,因此 LAMP 可直接用肉眼判斷 DNA 是否增幅。除了直接用肉眼觀測外,LAMP 也可搭配螢光試劑使用,若成功增幅 DNA 時,反應溶液會在UV光下發出綠色螢光,可幫助判斷反應結果。或者,可也在 LAMP 反應結束後直接加入 EtBr 及甲基藍,在UV光下觀察。
- 使用作用溫度65°C和具高DNA strand置換能力的DNA聚合酶如Bst DNA polymerase,此種酵素缺乏5’→3’的DNA分解能力,在DNA聚合的過程中,只能將模版DNA上既有的互補DNA鏈整條〝鏟〞起,就像是靠聚合酶進行dsDNA→ssDNA的步驟。
- 使用inner primers(FIP, BIP)和outer primers(F3, B3),或再加上loop primers(Loop F, Loop B):inner primers與outer primers為反應所必須,在增幅的過程中分別扮演啟始引發與後續「self-priming」的角色,而loop primers則是互補於DNA 序列F1、F2 中間的片段,這個位置在LAMP的DNA product上,為stem-loop 結構的loop位置,有助於提升整個反應的效率;這三對引子在設計之時,Tm 值要控制在 60-65°C,以利DNA聚合時可達最佳效能,也因此提升了在溫度調控上的便利性及專一性。除了以上的優點,目前的研究皆肯定LAMP的靈敏度可達 10 copies以下。

FIP & BIP: Forward and Back inner primer
F3 & B3: outer primer Inner primer
相對於 outer primer 在 DNA 片段上的結合位置,是在其下游。 由於LAMP所選用特定DNA聚合酶的功能,致使在outer primer下游的inner primer 啟始合成的 DNA 鏈,在 outer primer 進行 DNA 聚合的過程中被鏟起。 而 inner primer 上 F1c & B1c 的序列,在 LAMP 的反應過程中,將形成主要 的 LAMP 啞鈴形模版 DNA。 - 設定在65°C之恆溫槽反應溫度,作用 35-60分鐘,終止反應後,可以magnesium pyrophosphate產生沈澱的方式,或利用SYBR GreenⅠ螢光顯色來判斷檢體的陰、陽性。因為作用時間短、可以肉眼直視結果,實為一極佳的核酸檢驗技術。
- 特殊的 Polymerase,以Bst Polymerase催化,在 65°C恆溫增幅,可打開雙股DNA (無須高溫 denaturing)。
- LAMP分子檢測技術原理圖解: